臨床開発支援

日本再生医療学会では、AMED再生医療ナショナルコンソーシアム事業の一環として、臨床研究および臨床開発における技術的・事務的課題の解決と再生医療の実用化を支援しています。
臨床研究や治験の準備・実行に際し、支援をご希望の方は、下記の 受付・お問合せフォームからご連絡ください。
※民間企業、研究機関・学術機関、また個別のご相談も、無償で受け付けております。
はじめにご確認ください
この事業は、主にヒトへの介入を伴う再生医療等の臨床研究や医師主導治験の実施および開発における技術的なボトルネックの解消を目的としております。支援をご希望される際は、まず以下の厚生労働省のサイトをご覧になり、再生医療等の概要をご理解の上、申し込みください。
再生医療等安全性確保法について
・法の概要について(厚生労働省サイト)
・再生医療等提供計画の提出等について(概要)(厚生労働省サイト)
・再生医療等提供計画等の記載要領等の改訂について(令和5年2月20日事務連絡)(厚生労働省サイト)
・細胞培養加工施設の各種手続きについて(厚生労働省サイト)
・「再生医療等安全性確保法における細胞保管に関する考え方」について(令和6年4月15日医政研発0415第2号)(厚生労働省サイト)
・ヒトその他の生物に由来する原料等を用いて製造した細胞加工物を使用する再生医療の提供に当たり留意すべき事項について(令和5年7月3日医政研発0703第2号)(厚生労働省サイト)

支援内容の紹介
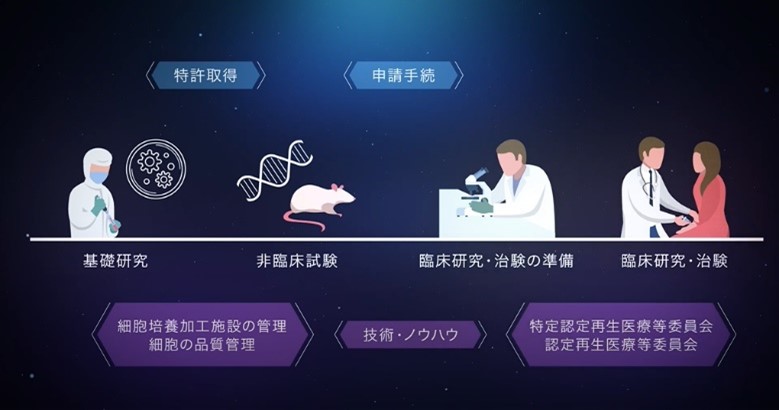
これまで限られた研究機関でしか得られなかった専門知識や技術的経験を、オールジャパンで活用できる仕組みを構築し、研究・開発に伴うさまざまなボトルネックを解消するための支援を行っています。
【提携機関】 12機関
大阪大学 京都大学iPS細胞研究所 慶應義塾大学 神戸アイセンター病院 国立医薬品食品衛生研究所 国立成育医療研究センター 順天堂大学 東海大学 東京大学 東京医科歯科大学 長崎大学 新潟大学
【支援実績】 50件 2024年3月現在(開始 2021年4月)
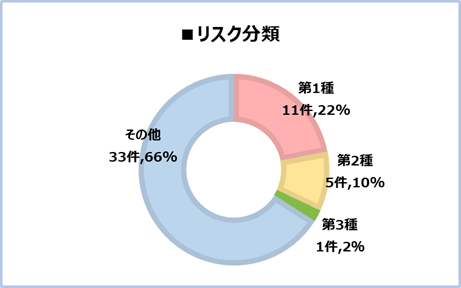
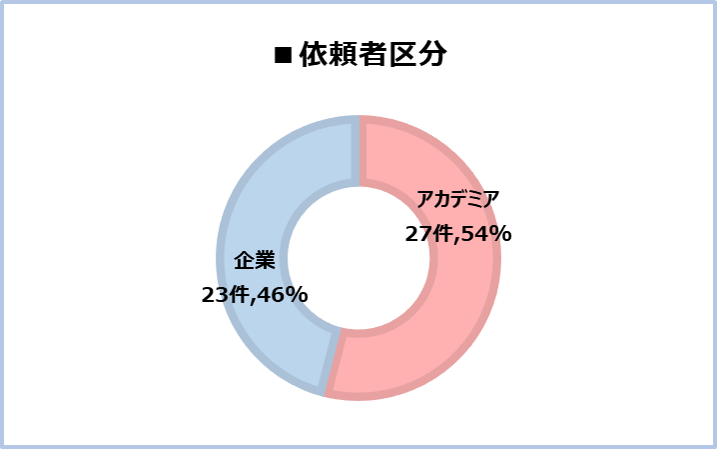
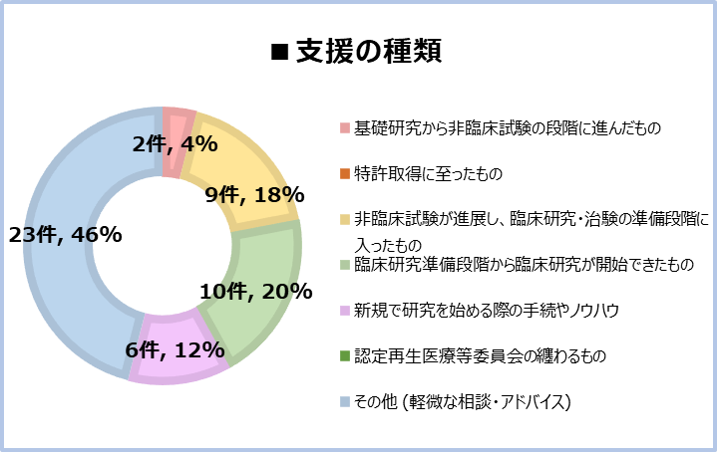
【支援例】~ネットワークを使って、どのようなご支援でも誠実に対応いたします~
● 幹細胞を用いた臨床研究・治験に係る細胞基盤技術支援
● 再生医療等製品および特定細胞加工物の原料としての同種細胞の供給に関する法的および倫理的課題に係る支援
● オルガノイド等を用いた再生医療開発戦略に係る支援
● 文部科学省ヒトES細胞の使用に関する指針に対する計画作成支援
● 小児に対する再生医療に関するELSI、前臨床研究、臨床研究に係る支援 等

ご依頼方法
下記の受付・お問合せフォームまたは、E-mail:cts@jsrm.jp までご連絡ください。
※ご希望がございましたら、秘密保持契約を締結させていただきます。

事業動画
支援担当者一覧 16名(50音順)

梅澤明弘
国立成育医療研究センター 研究所長
【専門分野】ヒトES細胞に基づく再生医療
【所属先HP】https://www.ncchd.go.jp/hospital/about/doctor/saibo/u01.html

江口 晋
長崎大学 大学院医歯薬学総合研究科 医療科学専攻 移植・消化器外科学 教授
【専門分野】消化器(肝胆膵、消化管)、移植(肝移植、膵移植、小腸移植)
【所属先HP】https://www.med.nagasaki-u.ac.jp/surgery2/

岡田 潔
大阪大学 大学院医学系研究科 医学部附属病院
産学連携・クロスイノベーションイニシアティブ 特任教授
【専門分野】整形外科、末梢神経外科、再生医療、規制科学
【所属先HP】https://www.med.osaka-u.ac.jp/pub/xii/

岡田尚巳
東京大学 医科学研究所 遺伝子・細胞治療センター 分子遺伝医学分野 教授
【専門分野】遺伝子・細胞治療
【所属先HP】https://www.ims.u-tokyo.ac.jp/imsut/jp/

岡野栄之
慶應義塾大学 医学部生理学教室 教授
【専門分野】分子神経生物学、発生生物学、再生医学
【所属先HP】http://www.okano-lab.com/

許斐健二
慶應義塾大学病院 臨床研究推進センター 教授
【専門分野】眼科学、レギュラトリーサイエンス、再生医療
【所属先HP】https://www.ctr.hosp.keio.ac.jp/

佐藤正人
東海大学 医学部医学科外科学系整形外科学 教授
東海大学 大学院医学研究科運動器先端医療研究センター センター長
【専門分野】整形外科、運動器(再生医療、先端医療)、軟骨代謝
【研究事業HP】http://cellsheet.med.u-tokai.ac.jp

佐藤陽治
国立医薬品食品衛生研究所 薬品部 部長
【専門分野】医薬品の品質評価、細胞加工製品のレギュラトリーサイエンス
【所属先HP】http://www.nihs.go.jp/cbtp/home/index.html

髙橋 淳
京都大学 iPS細胞研究所 臨床応用研究部門 神経再生研究分野 教授
【専門分野】神経再生(特にパーキンソン病に対する細胞治療)
【所属先HP】https://www.cira.kyoto-u.ac.jp/jtakahashi/index.html

髙橋政代
ビジョンケア 代表取締役
【専門分野】網膜変性疾患、黄斑部疾患、再生医療研究
【所属先HP】https://www.vision-care.jp/

田中里佳
順天堂大学 大学院医学研究科 再生医学担当 教授
【専門分野】形成外科、美容外科、フットケア、創傷治癒、創傷外科、血管再生、
足病関連の臨床、ヒト末梢血単核球、末梢血血管内皮前区細胞、
脂肪由来幹細胞、間葉系幹細胞、PRP等を用いた臨床研究、前臨床試験、
ヒト幹細胞を用いた臨床研究の手続き等、細胞加工施設の設立から運用管理
【所属先HP】①順天堂大学大学院医学研究科 再生医学
https://www.juntendo.ac.jp/graduate/laboratory/labo/saisei/
② 順天堂大学大学院医学研究科 難病の診断と治療研究センター
https://research-center.juntendo.ac.jp/nanbyo/
③順天堂大学医学部 形成外科学講座
https://www.juntendo-plasticsurgery.com/
④順天堂医院 足の疾患センター
https://www.juntendo.ac.jp/hospital/clinic/footcare/

寺井崇二
新潟大学 大学院医歯学総合研究科 消化器内科学分野 教授
新潟大学コア・ステーション 医歯学系附属 未来医療研究開発センター(エクソソーム・デザイナー細胞)センター長
【専門分野】間葉系幹細胞、細胞外小胞(エクソソーム)、消化器病学、肝臓病学
【所属先HP】https://www.med.niigata-u.ac.jp/in3/index.html

飛田護邦
順天堂大学 革新的医療技術開発研究センター 先任准教授
【専門分野】レギュラトリーサイエンス、再生医療、歯科
【所属先HP】https://gaudi-juntendo.jp/

西田幸二
大阪大学 大学院医学系研究科・医学部 脳神経感覚器外科学 (眼科学) 教授
【専門分野】眼科学、再生医学
【所属先HP】https://www.med.osaka-u.ac.jp/pub/ophthal/www/index.html

本間康弘
順天堂大学 医学部附属 順天堂東京江東高齢者医療センター 整形外科 准教授
順天堂大学 大学院医学研究科 整形外科・運動器医学 准教授
【専門分野】整形外科・運動器医学
【所属先HP】①順天堂大学医学部附属 順天堂東京江東高齢者医療センター
https://hosp-gmc.juntendo.ac.jp
②順天堂大学医学部附属順天堂医院 整形外科・スポーツ診療科
https://www.juntendo.ac.jp/hospital/clinic/seikei/

森尾友宏
東京医科歯科大学 大学統合研究機構 高等研究院 プロジェクト研究部門 免疫・分子医学研究室 特別教授
【専門分野】免疫、血液、腫瘍、再生医療
【所属先HP】https://reins.tmd.ac.jp/html/100007048_ja.html
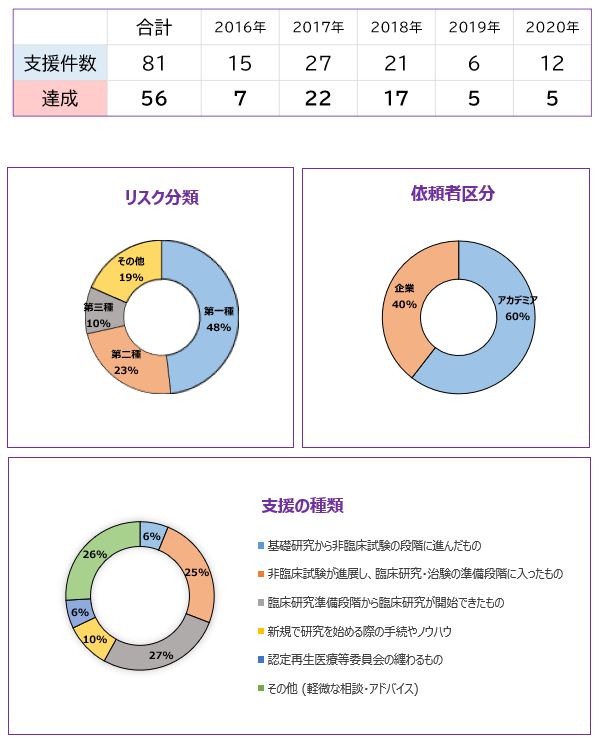
支援実績 ※2016-2020年度
監査業務
臨床研究の監査について

臨床研究における監査の目的は、法規制やプロトコル(計画書)、手順書(SOP)を遵守して行われていることを確認することにより、その臨床研究の品質保証のために実施されます。
また、倫理的側面から研究対象者の保護や実施体制、外部組織との委受託契約の状況、施設等の確認を行うこともあります。
監査とよく似た業務に「モニタリング」がありますが、モニタリングは研究の実施に係る品質管理を行う業務であるのに対し、監査は品質管理を含め、研究全体を第三者的立場でチェックするというところに大きな違いがあります。
よって監査では、「モニタリング業務が適切に行われているか」も確認することになるわけです。
現在、人を対象とする生命科学・医学系研究に関する倫理指針の一部や臨床研究法、再生医療等安全性確保法下においてモニタリングは必須とされており、多くの研究の品質の底上げはされてきたところではありますが、監査を取り入れ、適切な品質の評価と保証をされている研究はごく一部です。
そこで日本再生医療学会では、再生医療ナショナルコンソーシアム事業の一環として、臨床研究における監査業務を受託する運びとなりました。
対象となるものは、
・人を対象とする生命科学・医学系研究に関する倫理指針
・特定臨床研究
・再生医療等安全性確保法
に該当する研究となります。(※治験(GCP)は対象としません。)
当会の AMED 事業期間(2025 年 3 月まで)は、CRO で 10 年間、GLP/GCP/GMP の信頼性保証業務の経験のある担当者が、無償で監査業務を受託いたします。
臨床研究を実施する先生方の研究の品質担保の一助としてお役立ていただければ幸いです。
ご依頼方法
下記の受付・お問合せフォームまたは、E-mail:cts@jsrm.jp までご連絡ください。

